БИОЛОГИЧЕСКИ АКТИВНЫЕ ВЕЩЕСТВА
Основными биологически активными веществами (БАВ) софоры желтеющей являются флавоноиды, алкалоиды и полисахариды типа альфа-4,6-глюканы. Кроме того, корни софоры желтеющей содержат тритерпеновые сапонины, жирные кислоты, эфирные масла, хиноны, кумарины и т.д.
Алкалоидный состав корней этого растения изучен достаточно полно. Выделены и идентифицированы 12 хинолизидиновых алкалоидов трех групп – матрина, спартеина и цитизина, из которых большую часть составляют представители группы матрина.
Содержание суммы алкалоидов в корнях с. желтеющей, по данным разных авторов, колеблется от 0,4 до 2,0 %, в составе которых преобладают матрин и оксиматрин (около 80% от суммы алкалоидов) [Chen X. et al., 2004]. Следующий по содержанию идет алкалоид софокарпин и в следовых количествах были обнаружены софоранол, софорамин, софоридин, алломатрин, изоматрин и др. [Куваев, Блинова, 1961; Блинова, Архипова, 1967; Абдель-Баки, Блинова, 1980].
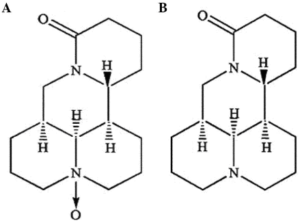
Maтрин и оксиматрин (рис.1) являются двумя основными алкалоидами, содержащимися в корнях софоры. Они были впервые выделены и идентифицированы в 1958 году. Матрины являются уникальными тетрацикло-хинолизидиновыми алкалоидами и обнаружены до сих пор только у представителей рода софора [Сакаева и др., 2001; Шретер и др., 2004; Mingyu Sun et al., 2012].
Исследование фенольных соединений софоры желтеющей продолжается уже более 40 лет и за это время обнаружено около 100 веществ, относящихся к различным классам флавоноидов, хинонам, антрахинонам, бензофуранам, кумаринам и фенолокислотам.
Благодаря разнообразию структурных типов фенольных соединений суммарные извлечения и фракции софоры желтеющей обладают широким спектром фармакологической активности, что подтверждено результатами многочисленных исследований [Оленников, Санданов, 2010].
Флавоноиды корня софоры желтеющей в основном представлены подклассом пренилированных флавоноидов с разнообразными углеродными скелетами – флаваноны, флавонолы, флаванонолы, халконы, изофлавоны – содержащие пренильную боковую цепь (аллил-, лавандулил- или др.). Из корней софоры был выделен ген пренилтрансферазы, отвечающий за пренилирование флавоноидов по 8-му положению. Все это является отличительной особенностью строения флавоноидов софоры желтеющей и обусловливает уникальность данного вида растительного сырья [Оленников, Санданов, 2010].
В последнее время возобновился интерес к этому подклассу соединений, поскольку в результате пренилирования флавоноидов их основная активность увеличивается [Shen et al., 2012], возрастает липофильность молекул и их сродство к биологическим мембранам [Barron et al., 1996] и как результат эта группа соединений отличается ценной биологической активностью. Пренилированные флавоноиды обладают высокой антиоксидантной активностью, показывают эстрогенное действие; изучается их противоопухолевая активность и возможность применения для профилактики и лечения болезни Альцгеймера. [Jung et al., 2010]
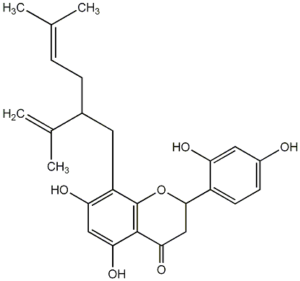
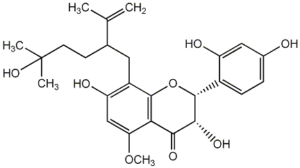
Пренилированные производные флаванона являются наиболее многочисленными (34 соединения), среди них известны изоксантгумол, софорафлаванон G (Рис.1), кураринон, изокураринон, личианон G, кушенолы А, E, F и др. Из производных флаванола и флаванонола (около 19 соединений) больше известны софофлавесценол (Рис.2), кушенолы Н, С и К (Рис.3).
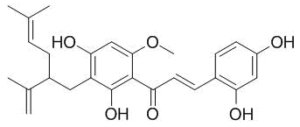
Пренилированные халконовые соединения софоры желтеющей представлены пятью лавандулил- и аллил-производными: ксантогумолом, кушенолом D, кураридином (Рис.4), кураридинолом и производным редкого класса пиранохромонов – циклокураридином.
Среди изофлавонов, соединений характерных для растений семейства бобовых, выявлено присутствие 13 веществ, включая такие известные соединения, как формононетин, генистеин, биоханин А. Кроме того, выделены пренилированные производные – кушенол О, флавесценон А и др.
Исследование содержания индивидуальных флавоноидов в корнях софоры желтеющей из разных регионов, показали существенные различия в их количестве и соотношении. Так, для китайских образцов наблюдается доминирование кураринола, кураридинола и норкураринона [Kyogoku et al., 1973; Wu et al., 1985a, b, c; Wu et al., 1986; Zhao et al., 1993], а по более поздним данным, кураринона, норкураринона и кушенола К [Ma et al., 2008а]. Сырье, собранное в Корее, отличается значительным содержанием кураринола и кушенола А [Kim et al., 2006; Jeong et al., 2008a, b], тогда как в японских образцах превалируют личианон G, кушенолы X и Q [Kuroyanagi et al., 1999].
Рис.2: Пренилированные флавоноиды: софорафлаванон G (1), софофлавесценол (2), кушенол К (3), кураридин (4)
Помимо упомянутых фенольных соединений в корнях софоры желтеющей обнаружены хинон кушехинон А, антрахинон хризофанол, кумарины умбеллиферон и 3,6-дигидроксикумарин, фенолокислоты и т.д..
Корни софоры желтеющей также содержат значительное количество полисахаридов, включая водорастворимые полисахариды типа альфа-глюканы, представляющие собой разветвленные гомоглюканы, содержащие в основной цепи остатки альфа-(1→4)-связанной глюкопиранозы, замещенной по положению С-6 единичными остатками альфа-глюкопиранозы. Установлено, что выделенные из растения альфа-глюканы обладают выраженным иммуностимулирующим действием [Оленников, 2012; Olennikov et al., 2011].
Тритерпеновые сапонины корней софоры желтеющей относятся к типу бета-амирина и представлены 5 гликозидами – соясапонин I, софорафлавозиды I — IV [Сакаева и др., 2001].
Также установлено наличие птерокарпанов, активных метаболитов бобовых растений – медикарпина, ангидровариабилина, кушенина, диоксибензофуран-птерокарпанов – маакиаина, птерокарпина, трифолиризина и др.
Остальные группы БАВ представлены в софоре желтеющей в минорных количествах.
Литература
- Абдель-Баки А.M., Блинова К.Ф. Алкалоиды корней Sophora flavescens // Химия природ. соедин. 1980. № 3. С. 426-427.
- Блинова К.Ф., Архипова Г.М. К химии рода софора — Sophora L. // Вопросы фармакологии. Л., 1967. Вып. 4. С. 100-109.
- Куваев В.Б., Блинова К.Ф. Предварительная химическая оценка лекарственных растений тибетской медицины, произрастающих в Забайкалье // Вопросы фармакогнозии. Л., 1961. Вып. 1. С. 194-195.
- Оленников Д. Н. Структурно-функциональное исследование биополимеров растительного и грибного происхождения и совершенствование методов их анализа // Автореф. дисс. док. фармац. наук. Улан-Удэ, 2012. — 40 с.
- Сакаева И. В., Саканян Е. И., Лесиовская Е. Е., Блинова К. Ф. Химический состав и фармакологические свойства корней Sophora flavescens Soland // Растит. ресурсы. 2001. Т. 37, Вып. 1. С. 111-123.
- Шретер А.И., Валентинов Б.Г., Наумова Э.М. Природное сырье китайской медицины. Справочник (в 3-х томах). М., 2004. Т.1. – 506 с.
- Chen X, Yi C, Yang X, Wang X. Liquid chromatography of active principles in Sophora flavescens root // J Chromatogr B Analyt Technol Biomed Life Sci. 2004. Dec 5; 812(1-2):149-63.
- Jeong G.S., Li В., Lee D.S., Byun E., An R.В., Рае H.О., Chung H.Т., Youn К.H., Kim Y.С. Lavandulyl flavanones from Sophora flavescens protect mouse hippocampal cells against glutamate-induced neurotoxicity via the induction of heme oxygenase-1 // Biol. Pharm. Bull. 2008 a. Vol. 31, N 10. P. 1964-1967.
- Jeong T.-S., Ryu Y.B., Kim H.Y., Curtis-Long M.J., An S. J., Lee J.H., Lee W.S., Park К.H. Low density lipoprotein (LDL)-antioxidant flavonoids from roots of Sophora flavescens // Biol. Pharm. Bull. 2008 b. Vol. 31, N 11. P. 2097-2102.
- Jung HA, Yokozawa T, Kim BW, Jung JH, Choi JS. Selective inhibition of prenylated flavonoids from Sophora flavescens against BACE1 and cholinesterases // Am J Chin Med. 2010. 38(2):415-29.
- Kim J.H., Ryu Y.В., Kang N.S., Lee B.W., Heo J.S., Jeong I.-Y., Park К.H. Glycosidase inhibitory flavonoids from Sophora Jlavescens // Biol. Pharm. Bull. 2006. Vol. 29, N 2. P. 302-305.
- Kuroyanagi M., Arakawa Т., Hirayama Y., Hayashi T. Antibacterial and antiandrogen flavonoids from Sophora flavescens // J. Nat. Prod. 1999. Vol. 62, N 12. P. 1595-1599.
- Kyogoku K., Hatayama K., Komatsu M. Constituents of a Chinese crude drug Kushen (the root of Sophora flavescens) // Chem. and Pharm. Bull. 1973. Vol. 21, N 12. P. 2733-2738.
- Ma X.-Ch., Xin X.-L., Liu K.-X., Zhang B.-J., Li F.-Y., Guo D.-A. Simultaneous determination of nine major flavonoids in Sophora flavescens by RP-LC // Chromatog- raphia. 2008 a. Vol. 68, N 5/6. P. 471-474.
- Mingyu Sun, Hongyan Cao, Lin Sun, Shu Dong, Yanqin Bian, Jun Han, Lijun Zhang, Shuang Ren, Yiyang Hu, Chenghai Liu, Lieming Xu, Ping Liu1. Antitumor Activities of Kushen: Literature Review // Evidence-Based Complementary and Alternative Medicine. Vol. 2012 (2012), Article ID 373219, 11 p. http://www.hindawi.com/journals/ecam/2012/373219
- Olennikov D.N., Stolbikova A.V., Rokhin A.V., Khobrakova V.B., Tankhaeva L.M. Polysaccharides of Fabaceae. V. α-Glucan from Sophora flavescens roots // Chemistry of Natural Compounds. 2011. Vol.47, №2. P.1-6.
- Wu L.J., Miyse T., Ueno A., Kuroyanagi M., Noro T., Fukushima S. Studies on the constituents of Sophora flavescens Aiton. II. // Chem. and Pharm. Bull. 1985 a. Vol.33, N8. P. 3231-3236.
- Wu L.J., Miyase T., Ueno A., Kuroyanagi M., Noro T., Fukushima S. Studies on the Constituents of Sophora flavescens Aiton. III. // Yakugaku Zasshi. 1985 b. Vol.105, N8. P. 736-741.
- Wu L.J., Miyase T., Ueno A., Kuroyanagi M., Noro T., Fukushima S., Sasaki S. Studies on the Constituents of Sophora flavescens Aiton. IV. // Yakugaku Zassh. 1985 c. Vol.105, N11. P. 1034-1039.
- Wu L.J., Miyase T., Ueno A., Kuroyanagi M., Noro T., Fukushima S., Sasaki S. Studies on the Constituents of Sophora flavescens Aiton. V. // Yakugaku Zassh. 1986. Vol. 106, N1. P. 22-26,
- Zhao Y.-Y., Wang В., Lei L.-M., Guo M.-J, Zhang R.-Y., Huang L.-R., Yi Y.-Y., Lou Zh.-C. Studies on the constituents of the flavonoids from the roots of Sophora flavescens Ait. // Acta Bot. Sin. 1993. Vol. 35, N 4. P. 304-306.